'Repuestos' sintéticos
Secciones
Servicios
Destacamos
Edición

'Repuestos' sintéticos
Lunes, 10 de Febrero 2025, 17:16h
Tiempo de lectura: 7 min
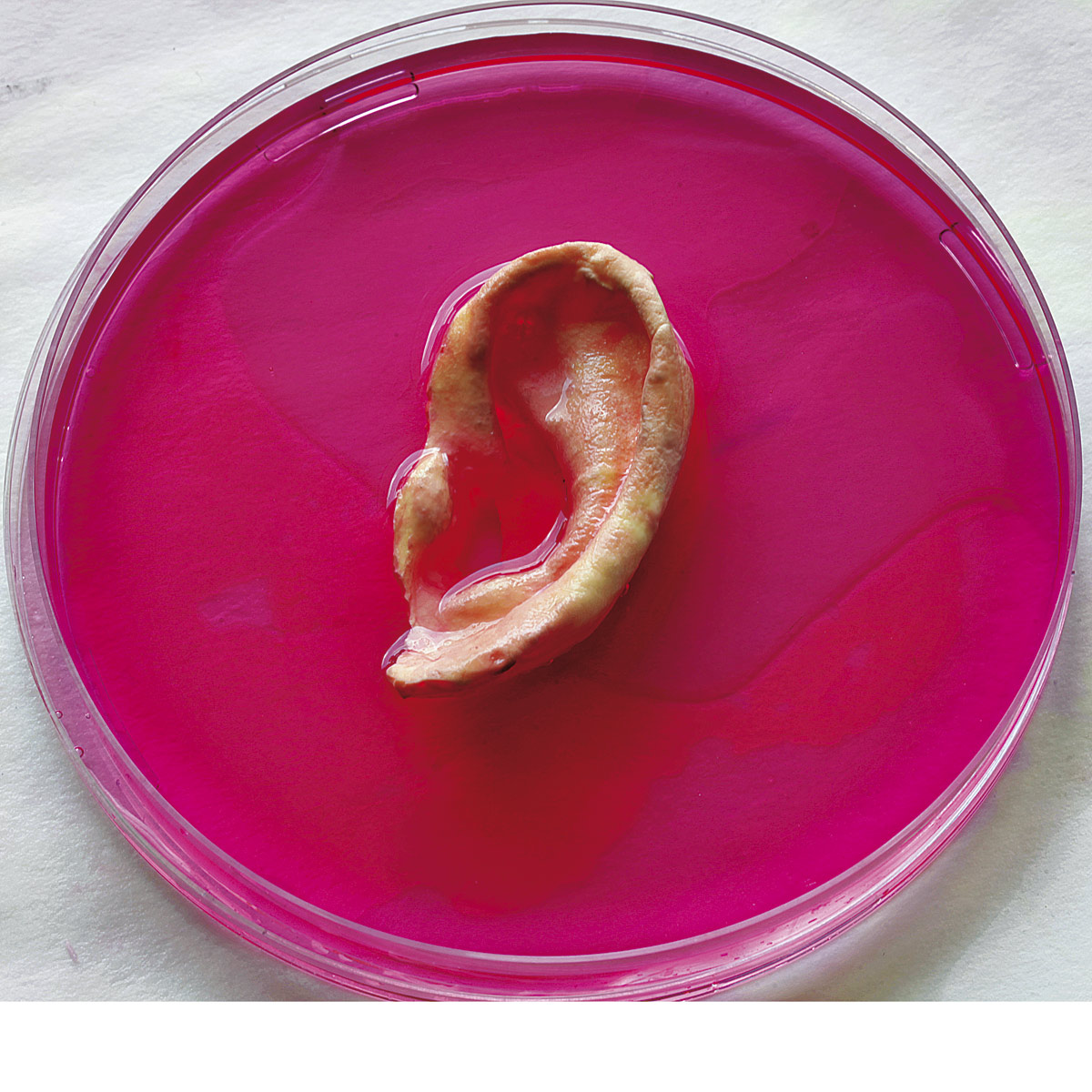
La donación clásica de órganos puede ser algo del pasado. A eso aspira Alexander Seifalian, un doctor Frankenstein moderno que lleva años empeñado en revolucionar la medicina regenerativa a golpe de bioingeniería y nanotecnología. Su centro de operaciones se sitúa en un pequeño y modesto laboratorio del Hospital Royal Free de Hampstead, al norte de Londres, Inglaterra, donde es profesor de Nanotecnología y Medicina Regenerativa en la División de Cirugía y Ciencias Intervencionistas de la University College London (UCL). «Es como una tienda de repuestos de partes del cuerpo humano», suele bromear. No obstante, en los vasos de precipitados se aprecian –entre fluidos viscosos– orejas, tramos de arterias, válvulas cardiacas, un conducto lagrimal o una tráquea. Todo sintético.

Este último ‘bioingenio’ lo catapultó a la fama cuando él y su equipo participaron en el primer trasplante del mundo de una tráquea artificial que integra células madre. Su creación era una réplica de la del paciente, un eritreo de 36 años con un tumor en la garganta que se propagaba hacia sus pulmones.
Utilizando imágenes 3D de la tomografía de tórax que les mandaron desde el Hospital Universitario del Instituto Karolinska de Estocolmo, Suecia –donde estaba ingresado el paciente–, su equipo del Departamento de Nanotecnología y Medicina Regenerativa creó un molde en vidrio de la tráquea y de los dos bronquios. Después, lo rellenó con el polímero líquido que han inventado y, al solidificarse, obtuvieron la réplica.
Luego la ‘regaron’ con las células madre, así llamadas por su capacidad de diferenciarse entre los 200 tipos celulares del organismo y, en teoría, de ayudar a reparar y regenerar cualquier tejido dañado. En este caso, las extraen de la médula ósea del paciente y las aplican a la pieza durante dos días, tras los cuales los millones de huecos en el tubo poroso son sembrados con nuevo tejido. Es decir, las células logran dividirse y crecer sobre este polímero convirtiendo la tráquea artificial en un órgano casi indistinguible de uno normal y sano.
![[ALTERNATIVE TEXT]](/xlsemanal/wp-content/uploads/sites/5/2024/12/metodo-doctor-seifalian-el-polimero.jpg)
![[ALTERNATIVE TEXT]](/xlsemanal/wp-content/uploads/sites/5/2024/12/metodo-doctor-seifalian-el-bioreactor.jpg)
![[ALTERNATIVE TEXT]](/xlsemanal/wp-content/uploads/sites/5/2024/12/metodo-doctor-seifalian-las-celulas-madre.jpg)
Tras aquel revolucionario trasplante, realizado el 9 de julio de 2011 en el centro sueco, el paciente evolucionó favorablemente. «Para confirmar el éxito de estos implantes deben ser probados en más pacientes en ensayos clínicos», dijo ya entonces el propio Seifalian, de origen iraní, que desde entonces recibió varios encargos adicionales de estas tráqueas sintéticas. Puede crearlas en cuestión de días, tras haber establecido el protocolo de fabricación y conocer mejor el comportamiento del ‘biomaterial’ con el que trabajan, cuya composición exacta es un secreto muy bien guardado.
No obstante, la UCL gastó de inicio más de 125.000 euros en las patentes de los nanomateriales desarrollados en este laboratorio, aunque el polímero es bastante barato de producir. Con 60 euros se pueden generar dos tráqueas. Una de las grandes ventajas de esta técnica, a la vanguardia científica mundial, radica en que, al utilizarse como ingredientes las propias células del paciente, se evitan los clásicos problemas del rechazo inmune del paciente trasplantado hacia el órgano recibido de otra persona. Además, cuando este método se perfeccione, eliminaría el problema de la disponibilidad de órganos y evitaría los tiempos de espera hasta encontrar un posible donante. Por no hablar de cómo podría cambiar la vida a miles de personas que sufren cualquier tipo de mutilación en la cara.
1981
Pioneros
Los médicos del Hospital General de Massachusetts, en Boston (EEUU), toman una pequeña muestra de piel de un paciente con quemaduras para generar células de este tejido sobre una matriz y acelerar el tratamiento.
1995
Primeros experimentos
El doctor Carlos Vacanti hace crecer un cartílago con forma de oreja en el lomo de un ratón de laboratorio, mediante la ‘siembra’ de células de cartílago bovino en el interior de un molde biodegradable con forma de oído.
1996
Clonacion
Nace la oveja Dolly, el primer mamífero en ser clonado a partir de una célula adulta. Sus creadores, Ian Wilmut y Keith Campbell, del Instituto Roslin de Edimburgo (Escocia), no anunciaron este hito hasta unos meses después, ya en 1997.
2008
Corazón bioartificial
Lo crea Doris Taylor, de la Universidad de Minnesota, con el órgano de una rata. Le despojó de sus células y sembró la matriz resultante con células madre para regenerarlo. Y sí, latió. Ese año, a su vez, se regeneró una tráquea en el Clinic de Barcelona.
2010
Lo que cuesta un riñón
Prototipo (no implantable aún) de un riñón artificial creado por científicos de EE.UU. que filtra las toxinas de la sangre y utiliza células humanas para realizar otras funciones vitales, como la regulación de la presión arterial o la producción de vitamina D.
Mientras se avanza a pasos agigantados en esa dirección, se van consiguiendo a la vez importantes hitos de carácter híbrido, en los que, si bien las células madre no pertenecen al propio paciente, sí se logra que conviertan un polímero artificial en tejido humano. Hace apenas días, se publicaron en la revista Nature, los esperados resultados de un experimento realizado con éxito en humanos en 2021. Ese año, una mujer con insuficiencia cardíaca grave —su corazón era incapaz de bombear sangre de manera eficiente— recibió un parche compuesto por 800 millones de células derivadas de un cordón umbilical. Tres meses después, al ser trasplantada, los investigadores examinaron su corazón y confirmaron la regeneración del tejido cardíaco. Este estudio —liderado por el Dr. Wolfram-Hubertus Zimmermann de la Universidad de Medicina de Gotinga y cuyos resultados definitivos muestran que ni la mujer ni los 20 monos a los que también se operó han evidenciado arritmias o tumores, dos de los más temidos efectos secundarios— demuestra por primera vez la posibilidad de regenerar el corazón humano mediante parches celulares. «Nuestro estudio es el primero que demuestra la remuscularización del corazón», afirma Zimmermann. Sin embargo, como en los trasplantes 'tradicionales', de donante a paciente, es necesario con esta terapia un tratamiento inmunosupresor de por vida para evitar el rechazo del implante. En todo caso, es un problema asociado 'menor' y muy manejable al hablar de una afección con un índice de mortalidad del 50 por ciento anual.
El propio investigador alemán Wolfram-Hubertus Zimmermann subraya la importancia de esta terapia: la insuficiencia cardiaca afecta a casi 65 millones de personas en todo el mundo, de las que al menos 6 millones sufren insuficiencia cardiaca avanzada. «El 99 de estos pacientes —ha explicado Zimmermann— nunca recibirán un trasplante de corazón. Nuestro objetivo es tratar a ese 99 por ciento».
El que fuera director de la Organización Nacional de Trasplantes, Rafael Matesanz, ha considerado que este campo que mezcla bioingeniería tisular y terapia celular va a dar lugar a los avances más espectaculares en el mundo de los trasplantes. En palabras de una de las investigadoras que trabaja en la creación de tejidos en el laboratorio: «Lo que estamos haciendo es descomunal».
